Tipos de sólidos en Química
La química es una ciencia fascinante que estudia las propiedades y composición de las sustancias. Dentro de este amplio campo, uno de los temas fundamentales es el estudio de los sólidos. Los sólidos son materiales que mantienen su forma y volumen en condiciones normales de temperatura y presión. En este artículo, exploraremos los diferentes tipos de sólidos y cómo se clasifican en base a su estructura y propiedades.
En química, los sólidos se pueden clasificar en diferentes tipos según su estructura cristalina, que se refiere a la disposición ordenada y repetitiva de sus átomos, iones o moléculas. Cada tipo de sólido tiene propiedades únicas que los distinguen de los demás. A continuación, presentaremos una lista de los tipos más comunes:
Tipos de sólidos:
-
Sólidos amorfos:
Estos sólidos carecen de una estructura cristalina ordenada y presentan una disposición aleatoria de sus átomos, iones o moléculas. Ejemplos de sólidos amorfos son el vidrio y el plástico. A diferencia de los sólidos cristalinos, los sólidos amorfos no tienen un punto de fusión bien definido, sino que se ablandan gradualmente a medida que se calientan.
-
Sólidos cristalinos:
Los sólidos cristalinos se caracterizan por tener una estructura cristalina ordenada y repetitiva. Están formados por átomos, iones o moléculas dispuestos en un patrón regular en el espacio tridimensional. Ejemplos de sólidos cristalinos son los metales, las sales y algunos minerales.
-
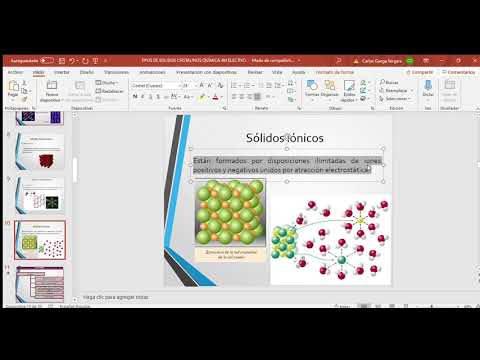
Sólidos iónicos:
Estos sólidos están compuestos por iones que se mantienen juntos mediante fuerzas electrostáticas. Los sólidos iónicos suelen tener puntos de fusión altos y son buenos conductores de la electricidad cuando se encuentran en estado fundido o en solución acuosa.
-
Sólidos moleculares:
Los sólidos moleculares están formados por moléculas que se mantienen unidas mediante fuerzas intermoleculares, como puentes de hidrógeno o fuerzas de London. Estos sólidos suelen tener puntos de fusión bajos y son malos conductores de la electricidad.
-
Sólidos covalentes:
Estos sólidos están formados por átomos unidos entre sí mediante enlaces covalentes. Ejemplos de sólidos covalentes son el diamante y el grafito. Los sólidos covalentes suelen tener puntos de fusión elevados y son materiales muy duros y resistentes.
-
Sólidos metálicos:
Los sólidos metálicos están formados por átomos metálicos que se mantienen unidos por enlaces metálicos. Estos sólidos tienen una estructura cristalina en la que los átomos metálicos están dispuestos en una red regular y compacta. Los sólidos metálicos son buenos conductores de la electricidad y el calor.
Estos son solo algunos ejemplos de los diferentes tipos de sólidos que existen en química. Cada tipo tiene sus propias características y propiedades físicas y químicas. La comprensión de estos diferentes tipos de sólidos es fundamental para el estudio y la aplicación de la química en diversos campos como la ingeniería de materiales, la nanotecnología y la farmacología, entre otros.
Preguntas frecuentes sobre los sólidos en química:
-
¿Cuál es la diferencia entre sólidos amorfos y cristalinos?
La diferencia radica en la estructura interna. Los sólidos amorfos carecen de una estructura ordenada y presentan una disposición aleatoria de sus átomos, iones o moléculas, mientras que los sólidos cristalinos tienen una estructura cristalina ordenada y repetitiva.
-
¿Cómo se forman los sólidos iónicos?
Los sólidos iónicos se forman a través de la unión de iones mediante fuerzas electrostáticas. Esto ocurre cuando un átomo cede electrones y se convierte en un ion positivo, mientras que otro átomo acepta electrones y se convierte en un ion negativo.
-
¿Qué propiedades distintivas tienen los sólidos covalentes?
Los sólidos covalentes son materiales duros y resistentes debido a los enlaces covalentes fuertes que los mantienen unidos. Además, tienen puntos de fusión elevados y son malos conductores de la electricidad y el calor.
-
¿Cuál es la estructura de los sólidos metálicos?
Los sólidos metálicos tienen una estructura cristalina en la que los átomos metálicos están dispuestos en una red regular y compacta. Esta estructura les confiere propiedades tales como la conductividad eléctrica y térmica.
-
¿Cuál es la importancia de comprender los diferentes tipos de sólidos en química?
La comprensión de los diferentes tipos de sólidos es fundamental para el diseño y desarrollo de nuevos materiales, así como para la comprensión de los procesos químicos y físicos que ocurren en los sólidos. Esto tiene aplicaciones en campos tan diversos como la medicina, la ingeniería y la tecnología.
Conclusión:
En resumen, los sólidos en química se clasifican en diferentes tipos según su estructura cristalina. Los sólidos amorfos carecen de una estructura ordenada, mientras que los sólidos cristalinos tienen una estructura repetitiva y ordenada en el espacio tridimensional. También existen sólidos iónicos, moleculares, covalentes y metálicos, cada uno con sus propias características y propiedades.
La comprensión de estos diferentes tipos de sólidos es esencial para avanzar en la ciencia y la tecnología. Los científicos e ingenieros utilizan esta información para desarrollar nuevos materiales con propiedades y aplicaciones únicas. Al conocer los diferentes tipos de sólidos, podemos comprender mejor el mundo que nos rodea y encontrar soluciones innovadoras para los desafíos del futuro.
Agradecemos tu tiempo y esperamos tus comentarios y preguntas en la sección de comentarios. ¿Qué tipo de sólido te resulta más interesante? ¿Qué aplicaciones crees que podrían surgir a partir de los sólidos en química? ¡Nos encantaría saber tu opinión!
Tenemos muchos mas temas relacionados con Tipos de sólidos en Química te invitamos a que visites el tema de Ciencia y te pongas al día con conocimientos sorprendentes!.
Deja una respuesta

Tipos Relacionados